歐唐靜?在歐盟被推薦用于治療成人慢性腎病
-? 歐洲藥品管理局?(EMA)人用藥品委員會(CHMP)的積極意見是基于具有里程碑意義的EMPA-KIDNEY試驗,這是迄今為止針對慢性腎病(CKD )的最大和最廣泛的SGLT2抑制劑試驗[1],[...
禮來聯合信達生物宣布達伯舒?在中國獲批用于經EGFR-TKI治療失敗的EGFR陽性非鱗狀非小細胞肺癌患者的治療
上海2023年5月10日 /美通社/ -- 2023年5月10日,今日禮來制藥(紐約證券交易所代碼:LLY)和信達生物制藥集團(香港聯交所股票代碼:01801)共同宣布,由雙方聯合開發的創新藥物PD...
達伯舒聯合貝伐珠單抗及化療獲得國家藥品監督管理局批準用于經EGFR-TKI治療失敗的EGFR陽性非鱗狀非小細胞肺癌患者的治療
美國羅克維爾和中國蘇州2023年5月10日 /美通社/ --?信達生物制藥集團(香港聯交所股票代碼:01801),一家致力于研發、生產和銷售腫瘤、自身免疫、代謝、眼科等重大疾病領域創新藥物的生物制藥...
禮來制藥宣布 Donanemab 治療早期阿爾茨海默病的臨床3期研究結果
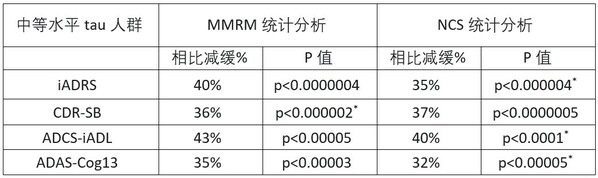
Donanemab 顯著減緩患者認知和功能的下降 近半數 (47%) 的donanemab受試者(安慰劑組為 29%)在用藥1 年后沒有出現臨床進展(定義為 CDR-SB評分?沒有下降)? 3 期試驗...
信達生物與禮來深化腫瘤領域戰略合作
美國舊金山,印第安納波利斯和中國蘇州2022年3月28日 /美通社/ --?信達生物制藥集團(香港聯交所股票代碼:01801),一家致力于研發、生產和銷售用于治療腫瘤、代謝疾病、自身免疫等重大疾病的...
信達生物聯合禮來制藥宣布達伯舒(信迪利單抗注射液)聯合吉西他濱和鉑類化療用于一線治療鱗狀非小細胞肺癌獲得國家藥品監督管理局批準上市
信達生物制藥今日和禮來制藥共同宣布,由雙方聯合開發的創新藥物PD-1抑制劑達伯舒 ?(信迪利單抗注射液)正式獲得國家藥品監督管理局的批準,聯合吉西他濱和鉑類化療適用于不可手術切除的局部晚期或轉移性鱗狀非小細胞肺癌 (NSCLC) 的一線治療。
美國FDA受理信迪利單抗聯合培美曲塞和鉑類用于治療一線非鱗狀非小細胞肺癌患者的上市申請
信達生物制藥今日和禮來制藥共同宣布,美國食品藥品監督管理局已經正式受理由雙方共同合作研發的創新PD-1抑制劑藥物信迪利單抗注射液聯合培美曲塞和鉑類用于非鱗狀非小細胞肺癌一線治療的新藥上市申請。
JS016與bamlanivimab雙抗體療法獲FDA緊急使用授權用于治療COVID-19
北京時間2021年2月10日,君實生物的全球合作伙伴禮來制藥宣布,美國食品藥品監督管理局(FDA)已批準其在研中和抗體藥物etesevimab1400mg和bamlanivimab700mg雙抗體療法的緊急使用授權(EUA)。
信達生物聯合禮來制藥宣布關于達伯舒?(信迪利單抗注射液)的六項研究結果將在2020歐洲腫瘤內科學會(ESMO)年會上公布
信達生物制藥今日和禮來制藥共同宣布,六項關于達伯舒(信迪利單抗注射液)的最新臨床研究成果將于9月19日至21日的2020年歐洲腫瘤內科學會(ESMO)年會線上大會上予以公布。
信達生物攜手禮來制藥公布信迪利單抗治療復發或難治性經典型霍奇金淋巴瘤相關研究的長期隨訪數據
信達生物制藥和禮來制藥共同宣布在第56屆美國臨床腫瘤學會年會(ASCO)上通過壁報的形式公布了雙方共同開發的信迪利單抗治療復發或難治性經典型霍奇金淋巴瘤(r/r cHL)(ORIENT-1研究)的長期隨訪數據。
信達生物攜手禮來公布信迪利單抗二線治療局部晚期或轉移性食管鱗癌的關鍵臨床研究結果
信達生物制藥和禮來制藥共同宣布在第56屆美國臨床腫瘤學會年會(ASCO)上通過壁報討論的形式公布了雙方共同開發的信迪利單抗二線治療局部晚期或轉移性食管鱗癌(ORIENT-2)的關鍵臨床研究結果。
達伯舒?(信迪利單抗注射液)聯合健擇?(注射用吉西他濱)和鉑類化療一線治療鱗狀非小細胞肺癌III期研究達到主要研究終點
中國蘇州2020年5月7日 /美通社/ -- 信達生物制藥(香港聯交所股票代碼:01801),一家致力于研發、生產和銷售用于治療腫瘤、自身免疫、代謝疾病等重大疾病的創新藥物的生物制藥公司,今日和禮來...
國家藥品監督管理局受理達伯舒?(信迪利單抗注射液)用于治療一線非鱗狀非小細胞肺癌患者的新適應癥上市申請
中國蘇州2020年4月24日 /美通社/ -- 信達生物制藥(香港聯交所股票代碼:01801),一家致力于研發、生產和銷售用于治療腫瘤、自身免疫、代謝疾病等重大疾病的創新藥物的生物制藥公司,今日和禮...
信迪利單抗聯合化療一線治療非鱗狀非小細胞肺癌達到主要研究終點
信達生物制藥今日和禮來制藥共同宣布:雙方共同開發的創新PD-1抑制劑達伯舒的一項隨機、雙盲、3期對照臨床研究-- 達伯舒聯合力比泰和鉑類用于無EGFR敏感突變或ALK基因重排的晚期或復發性非鱗狀非小細胞肺癌一線治療期中分析達到主要研究終點。
禮來制藥宣布出售旗下抗生素品牌和中國生產工廠
2019年4月23日,美國印第安納州印第安納波利斯市 -- 禮來制藥今日宣布與中國醫藥公司億騰醫藥簽署協議,向其出售旗下抗生素產品希刻勞(R)和穩可信(R)在中國大陸的權利,以及位于蘇州的希刻勞(R)生產工廠。
勃林格殷格翰和禮來宣布與牛津大學達成合作
勃林格殷格翰與禮來制藥(紐約證交所:LLY)今日宣布與牛津大學達成一項學術合作。EMPA-KIDNEY 研究將探索恩格列凈用于慢性腎病患者時對腎臟疾病進展和心血管死亡發生的作用。
FDA批準禮來Lartruvo(Olaratumab)聯合多柔比星治療軟組織肉瘤
禮來制藥宣布:美國食品和藥品管理局批準Lartruvo(Olaratumab注射液,10 mg/mL)聯合多柔比星用于不適合根治性放射治療或手術但適合蒽環類治療的成人晚期軟組織肉瘤(STS)組織學亞型。
Baricitinib改善類風濕關節炎癥狀體征上優于阿達木單抗
美國印第安納波利斯2015年11月13日電 /美通社/ -- 禮來制藥(NYSE: LLY)和Incyte公司(NASDAQ: INCY)于近日在舊金山舉行的美國風濕病學會/風濕病...
禮來銀屑病研究藥物Ixekizumab達到兩項關鍵性三期臨床研究目標
禮來制藥今天公布了在柳葉刀雜志上發表的兩項關鍵性三期研究的詳細結果。在入組UNCOVER-2和UNCOVER-3臨床研究的2500多例患者中發現:ixekizumab 組的所有皮損消除測量指標均優于依那西普和安慰劑組。
禮來CYRAMZA(R) (RAMUCIRUMAB) 獲第四項FDA批準
禮來制藥獲美國FDA對于CYRAMZA(R)的第四項批準。目前,Cyramza還可聯合FOLFIRI化療用于貝伐單抗、奧沙利鉑和氟嘧啶治療期間或治療后出現疾病進展的轉移性結直腸癌患者。